胎盘植入是严重的产科并发症,在产妇中有较高的发病率。若在胎盘植入时徒手剥离胎盘,会引发大出血。病理学家依据胎盘植入子宫肌层的程度,将其分为 3 类(图 1):胎盘粘连(PC,placenta creta,绒毛粘附在子宫肌层上)、胎盘植入(PI,placenta increta,绒毛侵入子宫肌层)和穿透性胎盘植入(PP,placenta percreta,绒毛穿透全部子宫肌层)。超声诊断胎盘疾病有绝对的优势,但在临床,往往很难区分胎盘植入的几种类型,尤其是几种类型共存于同一胎盘时(图 2)。目前研究显示,产前有 1/2-2/3 的胎盘植入无法得到准确诊断。为了提高胎盘植入的诊断率,来自英国的 Jauniaux 等学者总结了胎盘植入的超声表现及相应的病理生理特征,文章发表在 2017 年第 6 期 Am J Obstet Gynecol 杂志上。
(一)胎盘植入的病理生理特征
关于胎盘植入的发病基础,最早的观点认为是原发滋养层细胞生物功能异常导致滋养层细胞侵入子宫肌层。目前最新的观点则认为是子宫内膜-肌层交界层继发性缺失导致胎盘异常植入。
(1)瘢痕种植
在分泌期,子宫内膜血供丰富,易于种植。此期的特征是:内膜基质细胞分化为蜕膜细胞,炎性细胞浸润,子宫内膜血管重建。
胎盘植入与手术破坏子宫内膜和平滑肌的完整性有关,如剖宫产、刮宫、徒手剥离胎盘、产后子宫内膜炎等。部分无手术史的初产妇发生胎盘植入则与其子宫处于病理状态相关,如双角子宫、腺肌症、粘膜下肌瘤等。这些病例提示子宫内膜轻微缺失或其功能受到干扰均会造成异常的胎盘粘附或植入。
瘢痕处子宫肌层的缺失通常与瘢痕部位表皮细胞再生障碍有关。分泌期子宫内膜白细胞募集可能也会受剖宫产瘢痕的影响。研究显示,有剖宫产史的经产妇相比阴道分娩的经产妇其子宫血流量明显下降,这表明瘢痕附近的血液循环受损,最终会导致瘢痕部位子宫肌层细胞的变性退化以及表皮细胞再生的缺失。
有剖宫产史尤其是有两次剖宫产史的妇女在下次妊娠时发生前置胎盘的危险性将是无剖宫产史的妇女的 2 倍。瘢痕妊娠指的是孕囊种植到瘢痕部位。胎盘植入与瘢痕妊娠并不是独立的,前者是后者的延续。
总之,子宫内膜-肌层交界层宏观或微观的损伤中断都会给孕囊优先种植在瘢痕部位创造条件,也会影响子宫内膜正常蜕膜化。
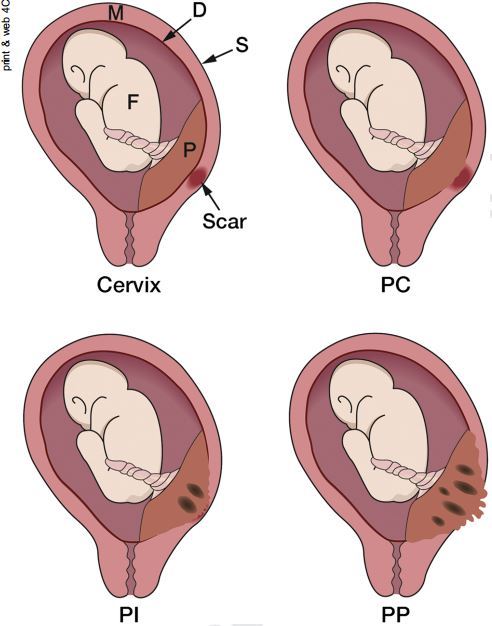
图 1 前壁瘢痕部位的前置胎盘(P)植入的不同分型:胎盘粘连(PC),胎盘粘附在子宫肌层;胎盘植入(PI),胎盘侵及子宫肌层(M);胎盘穿透(PP),胎盘侵及全部肌层(M)至浆膜层(S)
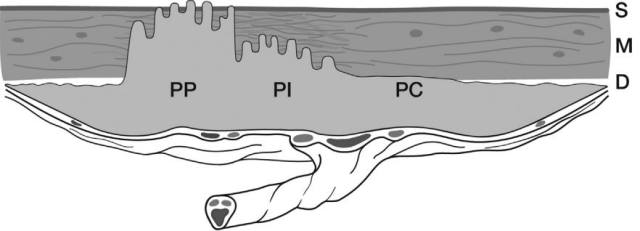
图 2 前壁 前置胎盘植入包含异常粘附及植入区域:胎盘粘连(PC),胎盘植入(PI),胎盘穿透(PP)
(2)瘢痕处胎盘形成
人类胎盘本身具有较高的侵袭性。囊胚种植于子宫内膜后,囊胚表面的单核滋养细胞开始增殖,经历由上皮细胞到间叶细胞的转化,最终失去增生潜能,并且通过蜕膜间质侵入子宫肌层,这些细胞统称为绒毛外细胞(EVT),它们最终分化为间质 EVT 和血管内 EVT 两个亚群。间质 EVT 侵入子宫肌层内 1/3,血管 EVT 侵入螺旋动脉官腔。间质 EVT 在子宫肌层内 1/3 融合成多核滋养细胞(MNGC),此区域被称为交界区(JZ)。EVT 的迁移依赖于自身分泌的一系列基质金属蛋白酶,包括胶原酶、明胶酶、基质降解因子。如果囊胚种植在瘢痕处,这些酶也会降解瘢痕组织。
当有胎盘植入时,EVT 侵入子宫肌壁更深的部位,这使得蜕膜基底层与胎盘之间缺乏间隙,分娩时很难将胎盘剥离。其机制有:(1)EVT 细胞过度表达血管内皮生长因子、磷酸酪氨酸免疫标记物,同时表达波形蛋白、细胞角蛋白-7,且具有表皮细胞向间叶细胞转换的特性及瘤样细胞表型;(2)EVT 细胞表达的可溶性 fms 样酪氨酸激酶(有效的抗血管生成因子)在 EVT 细胞运动及侵袭力方面有着重要的作用;(3)子宫胎盘血液循环受阻对细胞滋养层细胞的分化有着直接的影响;(4)子宫自然杀伤细胞释放细胞因子增强了 EVT 细胞的侵袭性。
(3)血管重建
子宫的血供由髂血管发出的子宫动脉升支和降支提供。子宫动脉在子宫肌层外、中层之间分支为弓状动脉,弓状动脉在子宫肌层浆膜下分布,放射动脉与弓状动脉垂直分布,呈放射状。二者的分支为基底动脉,位于子宫肌内层,其继续向子宫内膜方向分支为螺旋动脉,螺旋动脉进而分支为毛细血管丛。在非妊娠阶段,螺旋动脉和放射动脉血管壁有着丰富的平滑肌,其内分布的自主神经对肾上腺等激素有着较高反应性。
在正常妊娠胎盘中,EVT 细胞通过自身分泌的蛋白酶消化分解细胞间基质,进而穿过交接区(JZ),此时螺旋动脉的管壁结构及性状也发生改变。其特点是动脉管壁肌细胞减少,被大量纤维蛋白样物质取代。因此,这些动脉对激素的反应性降低,进而管壁扩张(图 3)。在正常妊娠,这些改变发生在妊娠中期。相反,JZ 以下滋养细胞未浸润的子宫肌层的放射动脉及弓状动脉对激素保持着高度敏感性。
在胎盘植入中,EVT 细胞的数量是增长的,但螺旋动脉的重建是不完全的。有假说称,母体免疫细胞释放的蛋白酶及细胞因子的缺失限制了局部动脉重建。在胎盘植入部位,有时候蜕膜是完全缺失的,可能是由于之前剖宫产形成的瘢痕部位血液循环障碍引起。但在胎盘异常粘附或植入中,螺旋动脉不完全重建并不会影响整个胎盘的功能。通常,在瘢痕部位血运受阻,但在胎盘植入部位,子宫弓状动脉和放射动脉是扩张的。
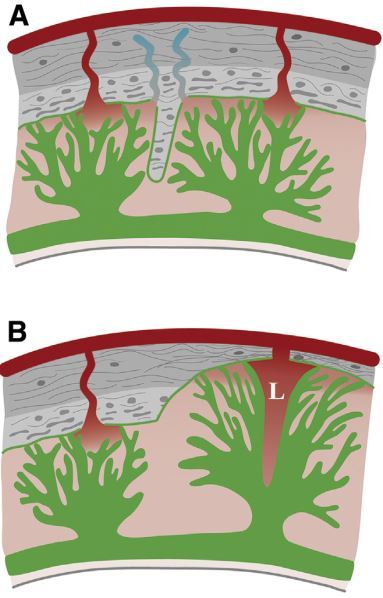
图 3 正常胎盘(A)和胎盘植入(B)中胎盘小叶抵达深层子宫肌循环。胎盘植入中,胎盘小叶形态扭曲,小叶间隔缺失以及存在胎盘腔隙(L)
(二)胎盘植入的超声表现
(1 透明带消失
胎盘床的解剖随着妊娠的进展会发生变化。在妊娠早期胎盘成型时,胎盘床由 2 层构成:第一层是含大量腺体及终末螺旋动脉的较厚的蜕膜层,第二层是含基底动脉的表浅肌层。随着妊娠进展,蜕膜层变薄且不连续,肌层由于子宫胎盘循环动脉扩张而变薄、不均匀。这两层形成了超声上胎盘后方的无回声区(图 4),即透明带。胎盘植入时,由于胎盘绒毛侵入子宫肌层,使得透明带变得不清楚。70% 的胎盘植入病例中表现出这一征象。
但有些学者认为,由于胎盘植入的表现是随着妊娠进程而不断变化的,透明带消失这一超声征象诊断胎盘植入并不准确。并且这一征象会随着胎盘在宫腔内的位置、探头加压、充盈膀胱(图 4 和 5)而变化,也会受瘢痕组织量的影响。
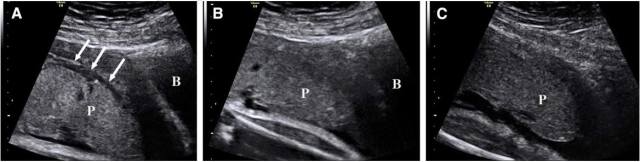
图 4 经腹胎盘长轴切面显示孕 32 周部分低置胎盘(P)。A,充盈膀胱(B)及探头未加压,B,探头加压,C,膀胱空虚及探头未加压。箭头所示为透明带的变化
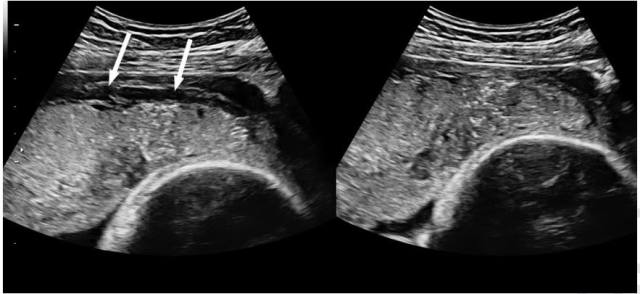
图 5 经腹胎盘长轴切面显示孕 34 周(有 3 次瘢痕妊娠史)孕妇在探头加压(右图)时胎盘透明带(箭头所示)的变化
(2)子宫肌层变薄
子宫肌层厚度<1 mm 或者超声上探测不到肌层成为产前诊断胎盘植入的另一征象。
胎盘位于较大的瘢痕组织处也会出现子宫肌层变薄这一征象,此处肌层比正常肌层薄,或者被瘢痕组织完全取代。随着妊娠进展,子宫肌层会变得越来越薄,但与胎盘植入无关。这一征象在妊娠晚期比较明显,主要是由胎儿运动和 Braxton-Hicks 宫缩双重作用导致。有时候,子宫肌层会部分裂开或变得极其薄以至于在分娩时胎盘看起来穿过子宫肌层。这一现象被称为「子宫窗」(图 6),它代表了肌层的缺失,而非异常胎盘植入。
在真正的胎盘植入中,特别是穿透胎盘,子宫肌层变薄或消失是由胎盘植入造成的。这不仅使得透明带消失,并且使子宫肌层回声改变,胎盘和子宫之间界限不清。当胎盘植入至浆膜层,胎盘和子宫的回声将分辨不清(图 7)。但需要特别注意的是,透明带、子宫肌层的厚度会受探头加压、产妇膀胱充盈的影响。
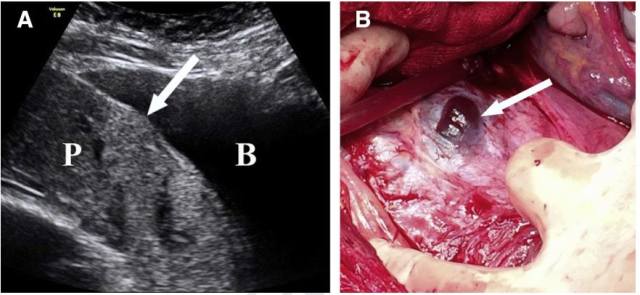
图 6 A,经腹胎盘长轴切面显示孕 36 周的前置胎盘,膀胱(B)与胎盘之间的子宫肌层及透明带缺失。B,手术标本显示「子宫窗」
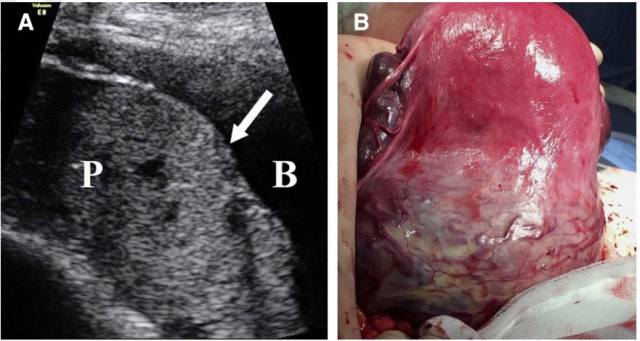
图 7 继发于胎盘(P)植入的子宫肌层变薄。A,经腹胎盘长轴切面显孕 36 周的前置胎盘,胎盘 (P)与膀胱(B)之间的透明带及子宫肌层缺失(箭头所示)。B,手术标本显示在胎盘植入部位存在大量新生血管及子宫肌层膨胀
(3)胎盘腔隙
胎盘腔隙是在胎盘植入时,胎盘内探及的数个不规则无回声区,呈「虫蚀状」(图 8 和 9),它是胎盘植入最常见的超声表现,与胎盘植入程度无关,也有人将其称为「胎盘湖」或「瑞士干酪」。
胎盘湖常位于胎盘小叶的中央,出现在正常妊娠早期,其外周回声会受绒毛间血栓、胎盘功能不全的影响。胎盘湖的数目、形状会随着孕龄、胎盘在宫腔内的位置、探头加压而变化(图 10)。
正常妊娠中的胎盘湖与胎盘植入中的胎盘腔隙之间的区别在于其数目、形状、位置、其内血流流速的不同。胎盘腔隙常位于胎盘局限区域内,呈数个、较大的不规则无回声。由于来自母体放射动脉或弓状动脉的高速血流充盈胎盘腔隙(图 11),胎盘腔隙可以将多个胎盘小叶扭曲。较大的胎盘湖也可以使胎盘局部变形(图 10),但由于胎盘湖内灌注的是螺旋动脉的血流(图 3),所以它对胎盘小叶形状的影响并不明显,并且在正常妊娠中,变形胎盘下面的子宫肌层的厚度是正常的。胎盘腔隙和胎盘湖在妊娠早期胎盘循环建立的时候更明显,其大小和形状会随着妊娠进展而变化。
「瑞士干酪」是葡萄胎时,用来形容绒毛水肿的词汇。相比胎盘腔隙和胎盘湖,「瑞士干酪」较小,且分布在胎盘的任意部位,其内无血流,所以用「瑞士干酪」来形容胎盘植入是不恰当的。
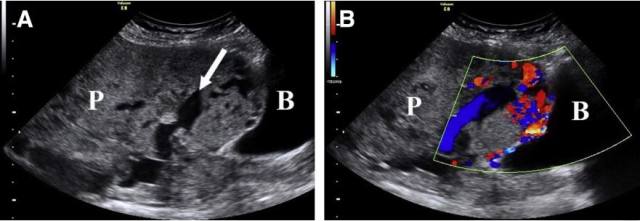
图 8 经腹超声显示孕 36 周前置胎盘植入。A,胎盘内数个不同大小、形状的「虫蚀状」胎盘腔隙;B,膀胱(B)旁的胎盘腔隙内彩色多普勒探及高速湍流血流信号
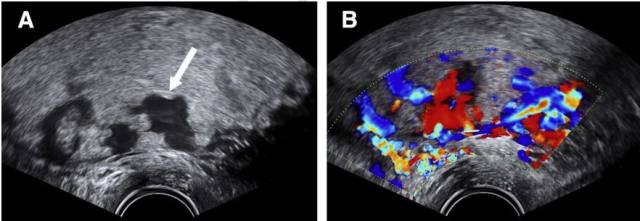
图 9 经阴道超声显示孕 20 周前置胎盘植入。A,胎盘内数个不同大小、形状的「虫蚀状」胎盘腔隙;B,胎盘腔隙内彩色多普勒探及高速湍流血流信号
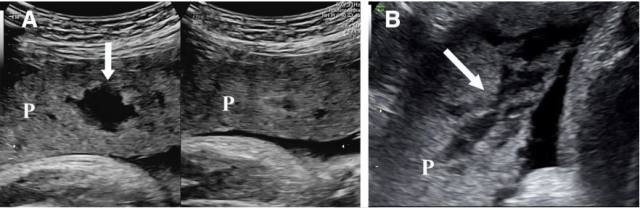
图 10 经腹胎盘长轴切面显示孕 33 周,无手术史及分娩时无胎盘植入的正常胎盘(P)。A,胎盘湖(箭头)在未施加探头压力(左图)及施加探头压力(右图)时的变化;B,大量和胎盘植入相似的虫蚀样胎盘湖
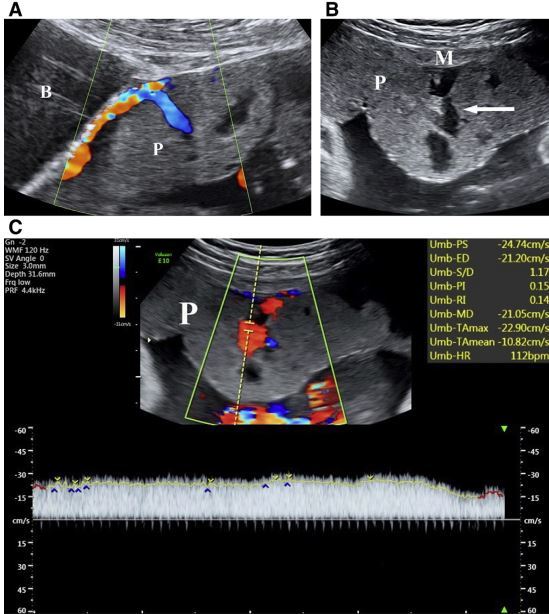
图 11 经腹胎盘长轴切面显示胎盘(P)。A,孕 20 周前置胎盘植入,显示胎盘与膀胱(B)之间来源于弓状动脉的分支动脉进入胎盘腔隙;B,正常妊娠孕 28 周的胎盘小叶中央的胎盘湖(箭头),子宫肌层(M);C,来源于螺旋动脉分支动脉的血流频谱
(4)膀胱壁中断
胎盘植入时,子宫浆膜层与膀胱腔之间的高回声线或者膀胱壁会中断、缺失或变得不规则。这一征象很可能是由绒毛直接侵犯膀胱壁而导致膀胱壁回声改变所致。但也可能是子宫前壁肌层和膀胱后壁肌层之间富含新生血管的折叠腹膜造成的超声伪像(图 12),超声检查时因注意鉴别。
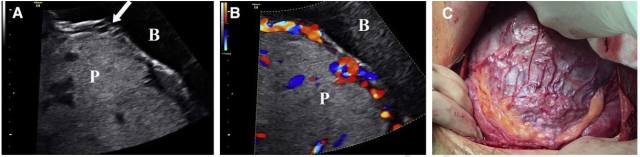
图 12 前置胎盘(P)植入,孕 28 周经腹胎盘长轴切面。A,膀胱(B)膨胀显示膀胱壁中断(箭头);B,彩色多普勒显示血管 桥;C,孕 34 周手术标本显示在胎盘植入部位子宫肌层膨胀以及存在大量新生血管
(5)胎盘膨胀
胎盘膨胀指的是子宫和胎盘偏离原来的位置(图 12)。这主要是由于绒毛穿透子宫肌层,破坏了子宫肌层的完整性,使得胎盘膨胀凸入周围组织。
(6)外生性肿块
与胎盘膨胀形成机制一样,外生性肿块也是由于绒毛穿透子宫肌层,破坏了子宫肌层的完整性,使得胎盘膨胀凸入周围组织而形成的肿块。
(7)胎盘下或子宫膀胱壁之间血管增多
在胎盘植入中,子宫胎盘循环血管扩张(包括螺旋动脉、放射动脉和弓状动脉)是产前 重要的超声表现,常伴有子宫膀胱之间折叠腹膜内血管增多。彩色多普勒可以清晰显示胎盘子宫血流情况(图 8 和 10)。81% 的 PI 和 75% 的 PP 存在胎盘床丰富血流。相比正常胎盘,PI 在子宫胎盘界面的血管分布不均匀,血管形态、大小不一致。结合超声,血管铸型及氧测量显示,胎盘床及子宫肌层内有着极丰富的网状动静脉瘘。绒毛侵及深层动静脉瘘可部分解释胎盘植入患者在分娩后子宫肌层持续有丰富血流,胎盘部位的血管分布、大小、形状异常的原因。
(8)胎盘腔隙分支血流
胎盘腔隙分支血流来源于子宫肌层深层血管(放射动脉、弓形动脉)抵达胎盘腔隙的分支血管(图 11)。正常胎盘与胎盘植入中,胎盘腔隙分支血流在胎盘床中所占面积是相似的,但在胎盘植入中,其血管较正常妊娠稀疏、粗大。
(9)血管桥
血管桥是指彩色多普勒显示来源于子宫肌层的血流一直延续至膀胱(图 12)。然而,这其实是腹膜内扭曲的新生血管产生的超声伪像,这些血管并未真正穿过子宫到达膀胱。
作者最后指出,胎盘植入三种类型常共存,故超声很难区分不同类型的胎盘植入。了解胎盘植入的超声表现及相应的病理生理基础,有助于超声医师在产前准确诊断胎盘植入,临床医生早期采取措施。
