卵巢癌是恶性程度最高的妇产肿瘤,也是 导致女性死亡的第 5 大病因,其总体 5 年生存率约为 46%。然而,若能在 I 期确诊,5 年生存率可达 90%,可惜约 70%~75% 的患者确诊时已经处于晚期(III 和 IV 期),此时 5 年生存率只有 28%。单独超声检查或与血清学检查结合可能 是早期发现卵巢癌以及区分卵巢肿块良恶性的最佳组合,然而超声的诊断效能似乎还有更大的提升空间。美国学者 Abramowicz 和比利时学者 Timmerman 分析总结了国际卵巢肿瘤研究组织(IOTA)出台的两种卵巢肿瘤恶性风险的超声评价方法,即超声简易标准(Simple Rules)和 ADNEX 模型(Adnexal model)的应用价值,文章发表在 2017 年第 6 期 Am J Obstet Gynecol 杂志上。
Simple Rules 将肿块分为良性、不确定性和恶性三类,而 ADNEX 则分为良性和恶性,若为恶性,则根据恶性风险分为几个阶段(交界性肿瘤、I 期、II-IV 期和卵巢转移性癌)。Simple Rules 和 ADNEX 模型的敏感性分别是 92% 和 96.5%,特异性分别是 96% 和 71.3%。然而,这两种方法并非用于卵巢肿瘤的筛查,而是对卵巢肿瘤进行术前分型。
初筛还是早期诊断卵巢癌?
宫颈癌筛查已在临床得到普及,然而卵巢癌还未能做到,目前主要是试图早期诊断(最好是 I 期)。
确定卵巢癌的高危人群主要依据个人病史和家族史,包括:(1)一级亲属有乳腺癌或卵巢癌病史;(2)遗传乳腺癌或卵巢癌相关的突变基因(如乳腺癌基因「BRCA1/BRCA2」和上皮细胞粘附分子微粒基因「MLH1,MSH2,PMS1,PMS2,MSH6」);(3)40 岁之前有乳腺癌病史;(4)患有遗传性非息肉病性结直肠癌(Lynch 综合征)。
卵巢癌的高危人群可能需要建议进行选择性基因检测。有 BRCA1/BRCA2 突变的女性建议每半年或一年复查经阴道超声检查(TVS)和 CA-125。然而,目前还存在一些未明确的相关基因突变,其风险尚无法评估,也没有针对性防御措施。同时,由于卵巢癌发病率较低(10-15%),而大规模筛查也需要高昂成本,因此并不推荐经超声筛查卵巢癌,也不评估发展为癌的风险,而是希望早期诊断卵巢癌。
美国妇产科医师协会(ACOG)指出,目前尚没有用于卵巢癌筛查的有效手段。在美国,对于高危妇女,唯一被推荐的检查手段是每年一次的 CA-125 检测及 TVS。然而,该方法并不理想,超声只能探及卵巢发生病变后的表现,而不是病变前的前兆表现。另一种评估方法(卵巢癌恶性风险分析方法)将卵巢肿块进行危险分层,评价指标包括血清 CA-125 和 HE4(人附睾蛋白 4)水平,盆腔肿块被分为恶性高风险和低风险两类。然而,该方法与 CA-125 单个指标相比并没有优势,也不是一种筛查手段。与之相似的采用各种血清标志物的其它诊断方法也都是用于早期诊断卵巢癌的模式。目前没有证据表明用以上方法在普通人和高危人群中筛查卵巢癌能够降低卵巢癌的死亡率。
超声检查早期诊断卵巢癌
早在 40 年前,文献中报道的经阴道超声联合彩色多普勒诊断早期卵巢癌的敏感性<90%,特异性 94%~99%,并非是每年扫查用于排除卵巢癌的最佳方法。对有症状患者情况会有所好转,但这些患者确诊时一般已经处于癌晚期。对高危患者,常规定期进行阴超检查相比未定期检查的患者,在减少患者死亡率方面并没有太大价值。目前而言,阴超检查最大的价值在于当探及卵巢肿块时区分肿瘤的良恶性。检查手段包括二维灰阶图像、彩色多普勒、频谱多普勒、三维超声检查(有或无多普勒)以及超声造影。超声造影有望提高卵巢肿瘤诊断准确率,特别是肿瘤生长因子靶向造影剂的应用。
早期卵巢肿瘤评分系统及风险预测模式
通过对卵巢肿块简单的观察和描述,产生了很多基于超声表现的卵巢肿瘤评分系统及风险预测模式,其中就包括 IOTA 的 Simple Rules 和 ADNEX 模型(表 1 和表 2)。最早诊断卵巢肿块恶性指标是将肿块分为单房囊肿、单房实性肿块、多房囊肿、多房实性肿块、纯实性肿块,后来将乳头状凸起也加入评价指标中,其诊断恶性肿块的敏感性和特异性分别为 82%、92%。恶性风险指数(RMI)的评价指标包括超声特征和 CA-125 水平,其预测原发卵巢上皮恶性肿瘤的特异性和阳性预测值(PPV)分别为 99.8%、19%。
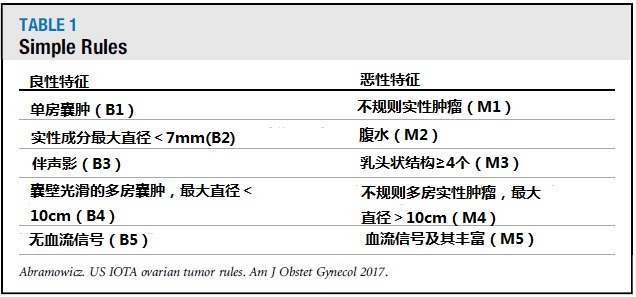
表 1 Simple Rules 的良性和恶性特征

表 2 ADNEX 的评价标准
卵巢肿瘤风险预测模式的效能
在 IOTA 的 Simple Rules 出台之前,RMI 用于评价卵巢肿瘤恶性风险优于其它风险预测模式。RMI I 和 RMI II(CA-125 水平,超声扫查,绝经期)联合评估的敏感性和特异性分别为 78%、87%。RMI IV 的敏感性、特异性、PPV、阴性预测值(NPV)分别为 86.4%、91%、63.5%、97.5%。据第一版的附件肿块国际共识报告(First International Consensus Report on Adnexal Masses)称,RMI 还没有像 IOTA 组织建议一样有用来描述超声表现或肿瘤分型的标准方法在美国实施。
什么是 IOTA?
IOTA 组织 1999 年由 Dirk Timmerman 等人建立,最初目的是规范用来描述附件区肿块超声表现的术语、形式、定义以及方法。IOTA 组织由全球 50 个临床中心(主要来自欧洲)参与构成,涉及妇产科、放射科、肿瘤科专家,以及很多基础学科专家,如物理学家、临床生物学家、土木工程师、数学家、心理学家、生物统计学家。
持续存在附件区肿块的大队列患者被纳入各个临床中心。IOTA 组织研究的重点在于预测评估附件肿块的恶性风险(如各种回归模型以及人工网络的应用),这些模式不是用来初筛卵巢癌,而是当超声探及附件肿块时确定肿块为恶性的风险。
由于各个超声检查者在超声描绘方面缺乏标准的专业词汇,IOTA 早期出台关于术语和定义方面的指导建议。后来,IOTA 研究发明了 Simple Rules 和基于逻辑回归 1-2 的精确诊断模式。Simple Rules 将肿块分为良性和恶性两类(图 1 和表 1)。若有 ≥ 1 个恶性特征且缺乏良性特征,则归类为恶性;若有 ≥ 1 个良性特征而缺乏恶性特征,则归类为良性;若良、恶性特征都有或都没有,则肿块归类为不确定性。在诊断恶性肿块没有延误的情况下,应用 Simple Rules 在无症状而存在有附件肿块的妇女中,相比 MRI 会导致更少的手术干预。一项 meta 分析结果显示,若将不确定性肿块都归类为恶性,则 Simple Rules 的诊断敏感性和特异性分别为 93%、81%。不管是经验丰富的超声科专家还是其它不同水平超声工作者,运用 Simple Rules 都可以达到较准确的诊断结果。Simple Rules 可以在 http://www.iotagroup.org/simplerules/ 上查到。
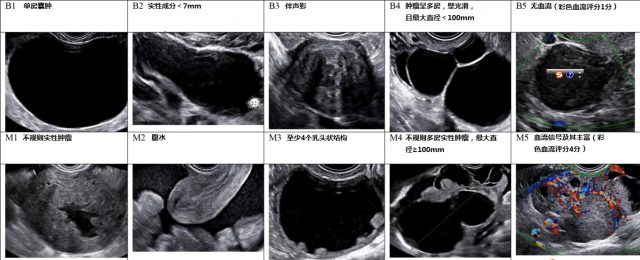
图 1 Simple Rules:超声良性表现(B),超声恶性表现(M)
IOTA 近期出台的 ADNEX 模型是第一个评价肿块良恶性的多分类模型,它将肿块分为良性、交界性、恶性早期(I 期)、恶性晚期(II-IV 期)、转移癌。评价指标包括 3 个临床指标和 6 个超声指标(表 2)。在临床实践中应用此模式时,结果以肿块良性或恶性的百分率呈现出来,若为恶性,则结果中包括它为交界性癌,恶性 I 期,恶性 II-IV 期,转移癌的风险百分率各为多少,此方法在区分卵巢肿块良恶性的 ROC 曲线下面积为 0.94。IDNEX 模型评价软件在 IOTA 网站上可以查询到(http://www.iotagroup.org/adnexmodel/site%20iota.html)。图 2 和图 3 为 2 个病例的软件评价结果。
Simple Rules 和 ADNEX 模型的目的是帮助临床医生对持续存在卵巢肿块的患者做出更加合理的分类及处理。然而,ADNEX 以及其它的评估软件不能替代训练有素的超声科大夫以及不能弥补低质量的超声检查设备。Simple Rules 和 ADNEX 模型比其它评估模式具有较高的应用价值(表 3)。
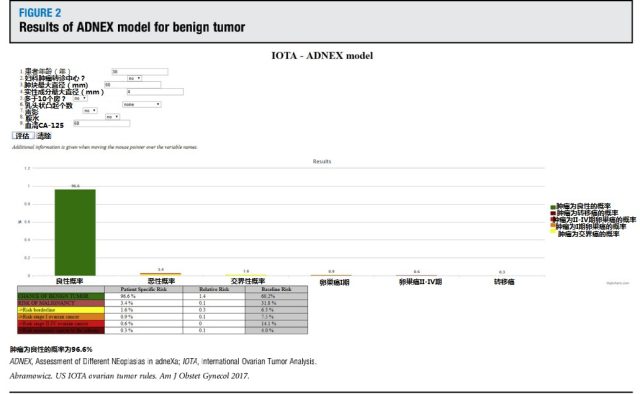
图 2 ADNEX 评估良性肿瘤的结果示例
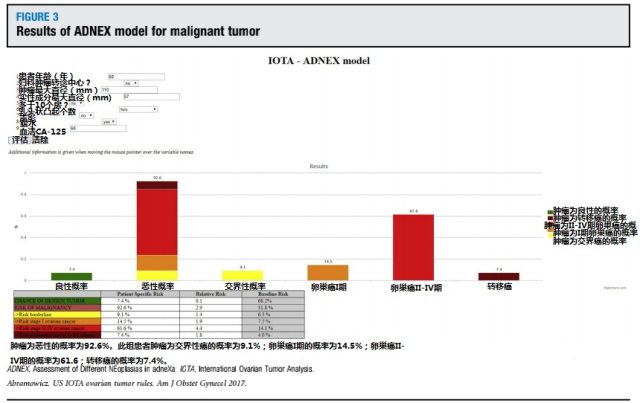
图 3 ADNEX 评估恶性肿瘤结果示例
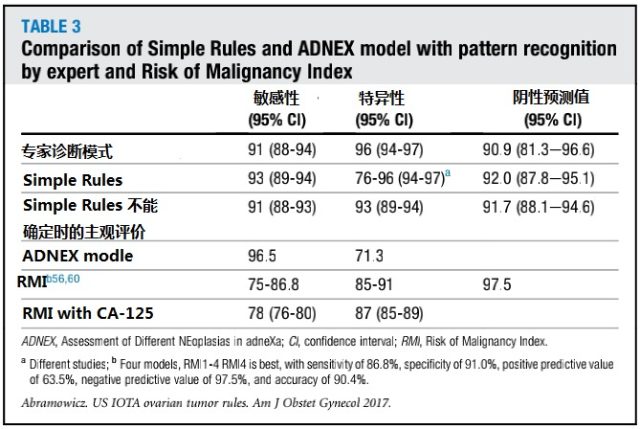
表 3 Simple Rules 、ADNEX 与专家诊断、恶性风险指数(RMI)比较
为什么 IOTA 的评估方法未能在美国普及?
在美国,大多数持续存在卵巢肿块的妇女,特别是绝经后妇女,也包括一些年轻妇女,临床都提倡采取积极的干预措施。一些不必要的诊断措施只有在原有的基础诊断方法不能充分区分良恶性时才采用。
绝经后妇女卵巢癌的发病率达到了 1/2500,因此一个诊断方法的 PPV(阳性预测值)至少要达到 10%,对于早期卵巢癌敏感性 ≥ 75%,特异性 99.6% 是临床所期望的。此外,卵巢癌最终确诊还是要依赖手术切除肿块的病理诊断。10% 的阳性预测值意味着术前诊断为阳性的病例中,经手术切除病理证实,每 10 例手术中只有 1 例是真正的卵巢癌。这个数据在美国可以接受。据 IOTA 数据统计,在一般的医疗中心,每 5.9 例手术中有 1 例是真正的卵巢癌,而在肿瘤医疗中心,这个数值为 2.3。美国妇产科医师协会(ACOG)/妇科肿瘤专业委员会 (Society of Gynecologic Oncology committee)意见中「妇产科医生在卵巢上皮癌早期诊断中发挥重要作用」在美国是被推荐的,但事实上,具体并不知道如何实施。
对于低危患者,似乎没有任何检查手段对卵巢癌早期诊断是有效的。对于高危患者,建议每 6 月复查阴超和血清 CA-125。妇科专业委员会意见中建议,阴超检查评价指标应包括肿瘤大小、形态、壁的特征以及是否合并有腹水,其敏感性和特异性分别为 86%、99%,但具体扫查细节并未给出。当肿块为可疑恶性(绝经后妇女:CA-125 升高或合并腹水,盆腔结节或混合性肿块,有腹部或远处转移的证据;未绝经妇女:CA-125 明显升高,合并腹水或有腹部或远处转移的证据)时,建议找经过多年肿瘤手术培训的专家诊治。
应用 IOTA Simple Rules 可以取得更高的诊断效能。在近期的一项研究中发现,遵循专家意见下应用 IOTA Simple Rules,阴性预测值(NPV)可高达 94.9%,相比其它评估方法,具有较明显的优势。以下 3 种情况可考虑应用 IOTA Simple Rules:(1)有卵巢肿块,其卵巢癌处于早期浸润阶段或是交界癌且没有经济或技术条件进行卵子或胚胎冷冻,有强烈保留生育功能要求的年轻女性;(2)有相对更高手术风险的心肺或其它疾病的患者;(3)离专业医疗机构较远的患者,特别是偏远地区的患者。
针对这 3 类患者,如果有一种有很高诊断信心的诊断方法将卵巢肿瘤进行分类,则会减少很多不确定性诊断,避免很多患者长途跋涉远处就诊,进而减少患者的焦虑和远处就诊的费用及时间。基于卵巢肿块恶性分险,术前可以选择开腹还是腹腔镜手术。目前没有生化指标证明比有经验的超声医师在评估卵巢肿块恶性分险方面有优势。
像 Simple Rules 等 IOTA 出台的简易诊断方法也许对经验丰富的超声科专家来说作用不大,但却能够帮助到妇产科医生和未经过正规超声培训的超声医师。事实上, Simple Rules 等简易诊断方法的目的是帮助妇产科及其它专业的医生对患者卵巢肿块的良、恶性风险进行判断,而不是超声科专家(显然,对超声科专家帮助也很大)。同样,ADNEX 的目的是对患者进行分类,从而采取合适的治疗措施。
IOTA rules 未能在美国普及的一个重要原因在于未能在美国得到认可。所有的 IOTA 研究源自其它国家,而非美国。如参与制定 Simple Rule 的国家有比利时、法国、意大利、瑞典、英国。参与制定 ADNEX 的国家有比利时、加拿大、中国、捷克共和国、法国、意大利、波兰、西班牙、瑞典、英国。事实上,此篇临床意见的编者有 3612 个是 IOTA 成员,只有 10 个编者来自美国。希望 IOTA Simple Rule 和 IOTA 能够在美国广泛用于卵巢肿块的回顾性分析或多中心前瞻性研究中。
