超声造影(CEUS)在肿瘤学的应用价值显而易见,实体恶性肿瘤可通过特征性的增强模式得以确认,而且还可根据通过肿瘤血管的变化来确定对治疗的反应。美国学者 Gummadi 等撰文对 CEUS 在肿瘤学中的新进展进行了综述,文章发表在 2018 年第 4 期 Abdom Radiol 杂志上。
1. 超声造影剂
目前有多种超声造影剂有售,其安全性好,可应用于肝肾功能受损的患者,无放射性,报道的副作用相对较轻,包括头痛、头晕、恶心和极少的过敏反应。
在美国,超声造影剂 Opsion、Definity 和 Lumason 被批准用于超声心动图检查,后者还被批准用于肝脏超声检查,Sonazoid 虽在美国未获准使用,但在韩国、挪威和日本被批准用于肝脏局灶性病变。
2. 技术考虑
超声造影并不适用于一般性检查。与 CT 或 MRI 不同,超声造影甚至比传统超声更依赖操作者,这可能成为许多机构采用超声造影的障碍。
为避免气泡空化/破坏,应使机械指数 (MI) <0.3。检查时建议使用分屏模式,在 CEUS 图像旁边显示灰阶图像以改进解剖定位,并记录每一可疑病变的超声造影动态影像。为避免破坏造影剂气泡,静脉注射时应采用 20 G 以上导管。通常建议团注给药,但若需要定量增强分析或扩大检查,也可输注。若需重新检查,应在现有微泡完全消除后重复注射,通常为 5-10 分钟后。
3. 局灶性病变特征
3.1 肝局灶性病变
与 CT 或 MRI 造影增强相似,肝局灶性病变也可通过 CEUS 的增强时间和三期增强模式来确定其特点(表 1)。通常,良性病变倾向于整个门脉相和延迟相都保持强化 (不包括单纯性囊肿),可根据其增强模式加以区分。恶性病变的动脉相强化程度参差不齐,门脉相及延迟静脉相明显廓清。2017 年,美国放射学学院 (ACR) 基于这些特征发布了的 CEUS Li-rads 系统,以规范肝细胞癌的诊断。
表 1 肝脏局灶性病变的 CEUS 表现
病变 | 动脉相 | 门脉相 | 延迟静脉相 |
单纯囊肿 | 无增强 | 无增强 | 无增强 |
血管瘤 | 周边增强 | 向心充盈或周围球状增强 | 高增强 |
局灶结节性增生 | 中央增强 | 高增强伴中央疤痕 | 高增强 |
肝腺瘤 | 可变增强 | 可变增强 | 可变增强/低增强 |
肝细胞癌 | 高增强 | 等/无增强 | 低/无增强 |
胆管细胞癌 | 边缘增强 | 低增强 | 无增强 |
转移病变 | 快速高增强(富血供)/边缘增强(弱血供) | 等/无增强 | 低/无增强 |
典型应用:患者女,33 岁,CT 增强扫描显示肝左叶 1.2 cm 的不确定性低密度病变,欲行超声引导下肝活检。经讨论,首先行 CEUS 检查发现病变大小 1.4×1.3×1.6 cm,动脉期周围不连续球状强化 (从图像左侧延伸到病变中心),无廓清 (图 1)。病变确定为血管瘤,未再活检。
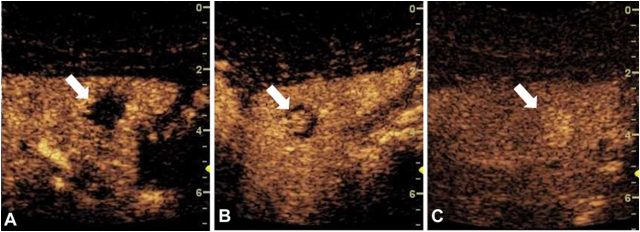
图 1 CEUS 示肝脏病变 (箭头) 周围不连续的球状强化 (从图像左侧开始延伸至病灶中心),中心进行性充盈,持续强化,符合血管瘤。A,团注后 16s;B,团注后 39 s;C,团注后 167 s
3.2 肾局灶性病变
肾脏实性肿块若 CEUS 造影后增强并早期廓清高度提示恶性,肾静脉血栓若造影后增强则可提示为瘤栓,肾脏囊性肿块 CEUS 后若出现结节状或较厚分隔强化和/或病变处不均匀斑片状强化则提示恶性。相反,良性病变通常无强化或表现为薄的微弱强化的分隔。
典型应用:患者男,88 岁,非增强 CT 扫描发现外生性肾脏肿块 (图 2A)。因患有慢性肾病,行 CEUS 发现复杂囊性病变内无强化,符合良性出血性或蛋白质性囊肿 (图 2C)。
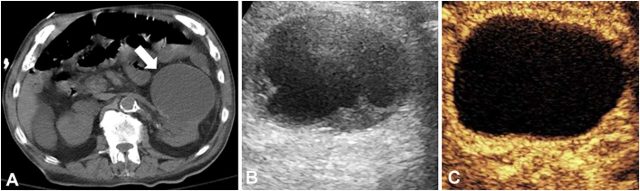
图 2 A,CT 显示左肾较大外生性肿块 (箭头);B,灰阶超声显示伴分隔的复杂囊性病变;C,超声造影显示内部无强化,考虑良性病变
4. 介入操作的影像引导
超声造影有助于区分肿瘤活跃生长区和坏死/囊性区,为介入穿刺活检提供实时影像指导,避免活检取样误差。此外,肿瘤灌注的即时分析还能对热消融治疗的反应进行实时反馈。
典型应用:患者男,65 岁,有黑色素瘤史,增强 CT 显示左侧腹壁 8 cm 肿块 (图 3A),外院多次超声和 CT 引导下的穿刺活检均仅发现坏死碎屑。CEUS 引导下行 18 G 针穿刺活检,将病灶中增强部分定为穿刺目标 (图 3C),最终病理结果符合转移性黑色素瘤。
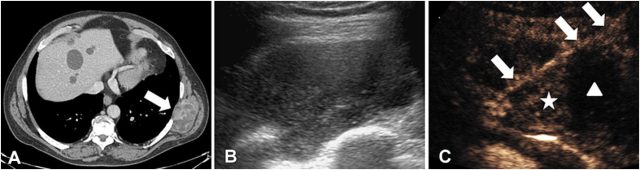
图 3 活检造影增强引导。(A) 在已知转移性黑色素瘤背景下,增强 CT 扫描显示左侧腹部肿块 (箭头),大小约 8x4x5 cm。(B) 灰阶超声显示大小约 8x4x5 cm 复杂的低回声病变。(C) 对同一病灶进行超声造影,显示清晰的灌注区 (星形) 和缺乏灌注的区域。活检针 (箭头) 穿过有灌注的病变区 (星形)。强化差的区域 (三角形) 代表病变的低灌注或坏死区域,这些区域不太可能提供明确的诊断。
5. 淋巴结的评估
CEUS 鉴别良恶性淋巴结价值有限,但若在肿瘤周围注射超声造影剂,则造影剂会沿相邻的淋巴管分布,从而可行实时追踪,与使用标准蓝色染料和示踪剂识别前哨淋巴结相比,CEUS 无需手术切开。然而,CEUS 辅助术前前哨淋巴结定位目前尚处实验阶段。
6. 肿瘤局部治疗后的早期评估
肿瘤的局部治疗包括冷冻消融、高温消融 (如微波消融)、经动脉化疗栓塞 (TACE) 、经动脉放射栓塞 (TARE) 等方法,CEUS 可能有助于肿瘤局部治疗后的早期评估,并作为有 MRI 或 CT 造影剂禁忌症患者的一种辅助评估方法。
典型应用:患者男,74 岁,CT 扫描显示右肾 3.4 cm 可强化肿块,考虑肾细胞癌 (图 4A)。由于患者不适宜外科治疗,行经皮冷冻疗法。术后 8 个月时 CEUS 检查显示消融后的空腔内无任何结节增强成分,表明治疗完全 (图 4C)。
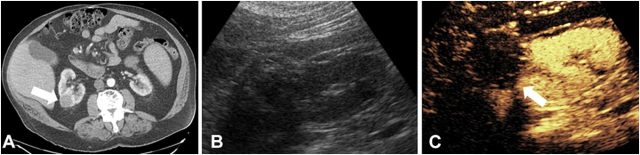
图 4 右肾可疑恶性肿块冷冻消融后的超声造影监测。A,增强 CT 示右肾 3.4 cm 病变伴软组织增强,考虑肾癌;B,右肾二维声像图;C,冷冻消融后 CEUS 图像显示消融腔内无强化,微小的周边强化提示术后瘢痕,无存活肿瘤
典型应用:患者男,65 岁,MRI 扫描显示为肝 Ⅵ 段 2.8 cm 病变,有动脉强化 (图 5) 和延迟期的快速廓清,确诊为肝细胞癌。患者经肝右动脉 Ⅵ 段分支行阿霉素药物洗脱珠的 TACE,1 周后行 CEUS 检查发现部分病灶仍有强化,符合残余存活肿瘤 (图 5C),后经 MRI 证实
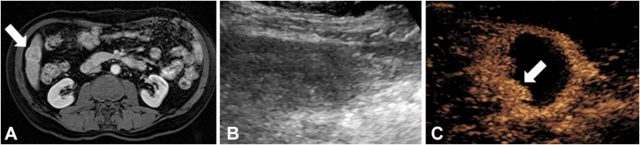
图 5 肝细胞癌经动脉化疗栓塞 (TACE) 后增强超声监测疗效。A,TACE 治疗前增强 MRI 发现 Lirads 5 类病变 (箭头),动脉期增强,延迟期快速廓清;B,灰阶超声无法显示治疗后的病变;C,同一声窗的 CEUS 显示病灶部分增强 (箭头),考虑肿瘤残留
结论
自 20 世纪 60 年代以来,CEUS 取得了显著进展,已成为介入放射科医师解决诊断难题的有效工具。最新应用包括病灶定位和疗效监测,随着 CEUS 在介入肿瘤学中创新作用的不断成熟,将对临床研究和工程创新产生重要的推动作用。
